中学理科|化学電池を完全マスター!定期テスト&入試で得点源にする6ステップ

電気を生む“魔法の反応”
化学電池の世界へようこそ!
「スマホも動かないし、ゲームもできない!電池が切れた!」
そんな経験、誰でもありますよね。私たちの生活は、いたるところで“電池”の力に支えられています。懐中電灯、リモコン、時計、さらには車のエンジン始動にも電池が使われています。でも、そもそも電池ってどうやって電気をつくっているんでしょう?
実は、電池の中では目には見えない化学反応が起こり、その反応によって電子(でんし)が流れ出しています。この「化学反応で電気を生み出すしくみ」をもつもの――それが、今回学ぶ 「化学電池」 です。
18世紀のイタリアで、ある科学者が偶然この“魔法の反応”を発見しました。
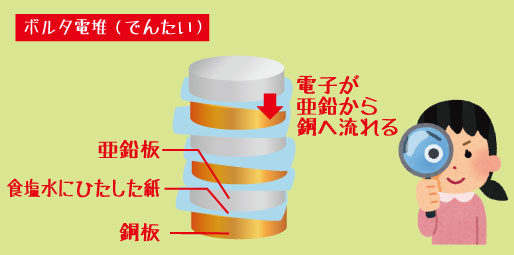
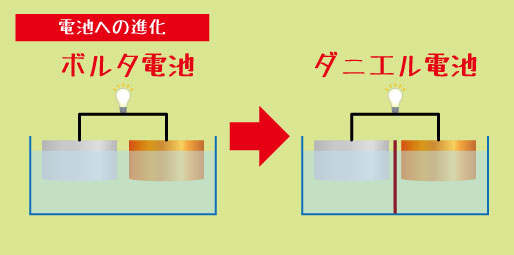
その名はアレッサンドロ・ボルタ。彼がつくった世界初の電池は「ボルタ電池」と呼ばれています。銅板と亜鉛板の間に食塩水をしみこませた紙をはさみ、何枚も重ねるだけ。それなのに、電流が流れ、電気を生み出すことができたのです。
これが、今日のスマホやパソコンの電源の“ご先祖さま”ともいえる発明でした。
このボルタ電池をきっかけに、人々は「化学反応で電気を取り出せる」ことを知りました。その後、改良を重ねて生まれたのが、みなさんが理科の教科書で習うダニエル電池です。そして、乾電池・燃料電池・リチウム電池など、現代の便利な電池へと発展していきました。
つまり、化学電池の学習=電気エネルギーの原点を学ぶこと。ここをしっかり理解すると、「電子の流れ」「酸化と還元」「エネルギーの変換」など、中学理科の大切な単元が一気につながります。
しかも、定期テストや入試でも毎年のように出題される“超重要テーマ”なんです。
このコラムでは、化学電池の基本から、ボルタ電池・ダニエル電池のしくみ、そして実際に出題されるテスト問題の対策まで、「6ステップ」でやさしく・ていねいに解説していきます。
理科がちょっと苦手でも大丈夫。電子の動きをイメージしながら読めば、きっと「なるほど!」が増えていくはずです。
では――さっそく次の章で、化学電池の基本しくみを見ていきましょう!
目次
第1章:化学電池の基本をおさえよう
電気を生むしくみとは?
「電池があると電気が流れる」
――それは知っていても、なぜ化学反応で電気ができるのか? と聞かれると、意外と答えにくいですよね。
この章では、化学電池の「中で何が起きているのか」を、イメージでつかみながら基本を整理していきましょう。
化学電池の3つの基本部品をおさえよう
化学電池は、大きく3つの部分からできています。
-
・−極(マイナス極):電子を出す金属
-
・+極(プラス極):電子を受け取る金属
-
・電解液:イオンが通る液体
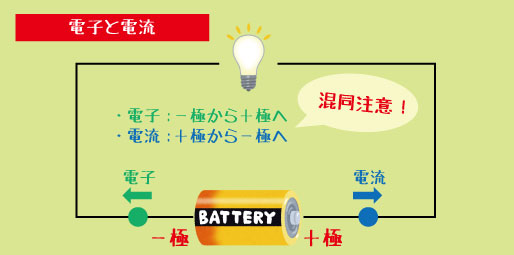
この3つがセットになると、電子が流れる“道”ができます。電子は「−極 → +極」へと流れ出し、その流れが電流になります。
ここで注意したいのは、
電子の流れる向きと、電流の向きは逆!
電子はマイナスからプラスへ動くのに対し、電流はプラスからマイナスへと流れると決められています。この部分はテストでよく出る“ひっかけポイント”です。
電子はなぜ動くの?― 金属の性質と反応の力
では、なぜ電子が勝手に動くのでしょう?
その答えは「金属の性質のちがい」にあります。金属の中には、「電子を放しやすい」ものと「受け取りやすい」ものがあります。
たとえば、亜鉛(Zn)は電子を放しやすく、銅(Cu)は電子を受け取りやすい金属です。
この2つを電解液につけて導線でつなぐと、亜鉛から銅へ電子が流れ、電流が生まれます。これが化学電池の基本のしくみです。
つまり、
「電子を出す金属」と「電子を受け取る金属」を組み合わせる
→ 電子の流れが生まれ、電気ができる!
ということですね。
化学電池の中では、金属の“性格のちがい”が電子の流れを生み出しています。
-
電子を出す側が「−極」
-
電子を受け取る側が「+極」
-
その間をイオンが行き来できるようにするのが「電解液」
この3つがそろってはじめて、電気エネルギーが発生します。
次の章では、いよいよ化学電池の原点「ボルタ電池」を見ていきましょう。世界で初めて“化学反応で電気を生み出した”その仕組みを、図で分かりやすく学びます!
第2章:化学電池の始まり
ボルタ電池とその発展
私たちが当たり前のように使っている乾電池。その原点は、今から200年以上も前のヨーロッパで誕生しました。それが「ボルタ電池」です。
この発明によって、人類は「化学反応から電気を取り出す」という革命的な一歩を踏み出しました。
この章では、ボルタ電池がどのようにして生まれ、どんなしくみで電気を生み出していたのかを見ていきましょう。
ボルタが挑んだ「電気の正体」
18世紀後半、イタリアの科学者ボルタは、当時注目を集めていた「ガルバーニのカエル実験」に興味を持ちました。ガルバーニは、カエルの脚に金属を触れさせるとピクッと動くことを発見し、「動物の中に電気がある」と考えました。
しかしボルタは、「電気は動物ではなく、金属同士の組み合わせから生まれるのでは?」と考えます。彼は銅板と亜鉛板という2種類の金属を、食塩水をしみこませた布をはさんで交互に重ねていきました。
すると――電気が流れたのです。これが、世界で初めて“連続的に電気を取り出すことができる装置”、ボルタ電池の誕生でした。
🧠 ポイント:
電気をつくるのは「生き物」ではなく「化学反応」であることを示した、歴史的な大発見!
ボルタ電池のしくみを見てみよう
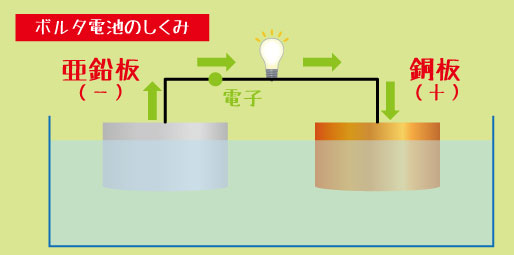
ボルタ電池は、「銅板(+極)」と「亜鉛板(-極)」を交互に重ね、その間に「食塩水を含ませた布」をはさむ構造になっています。
-
・亜鉛板(-極)では、亜鉛が電子を放出して溶け出します。
-
・銅板(+極)では、電子を受け取る反応が起こります。
-
・そして、電子は亜鉛から銅へと流れることで電流が生まれます。
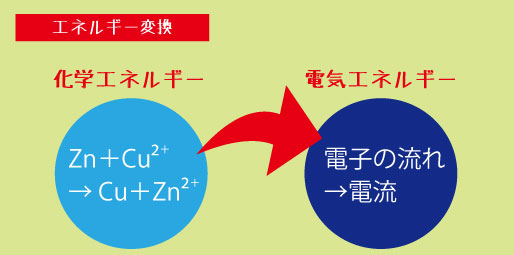
つまり、「金属の種類の違い」+「電解質(水溶液)」の組み合わせが、化学電池の基本原理なのです。
ボルタ電池の問題点と改良
ボルタ電池は画期的な発明でしたが、実は欠点も多くありました。
-
・食塩水の液がすぐに乾くため、長時間使えない
-
・電気の強さが安定しない
-
・気体(水素)が発生して電極を覆い、電流が弱まる(=分極)
このような欠点を改良するために、さまざまな「新しい電池」が登場しました。「ダニエル電池」や「グローブ電池」など。ボルタ電池は“はじまり”に過ぎず、この後の電池の発展を支えた重要な土台だったのです。
ボルタ電池は、「化学反応が電気を生み出す」ことを初めて証明した、まさに歴史的な発明でした。この発見をきっかけに、人類は“電気をつくる”という技術を手に入れます。現代の乾電池やリチウム電池まで、その原理はすべてボルタの発想からつながっているのです。
💡チェック!
-
・ボルタ電池のしくみは「金属+電解質+電子の流れ」
-
・化学電池の出発点は、200年前のボルタの挑戦から始まった!
第3章:ダニエル電池を完全理解
イオンと電子の動きを見える化!
ボルタ電池の登場によって、「化学反応から電気を取り出す」という考え方が広まりました。
しかし、ボルタ電池には“分極(ぶんきょく)”という欠点があり、長時間安定して電気を流すことができませんでした。そこで登場したのが、ダニエル電池です。この電池は、ボルタ電池の弱点を見事に克服し、より安定した電流を生み出せるようになりました。
この章では、ダニエル電池の構造や電子・イオンの動きをわかりやすく解説していきます。
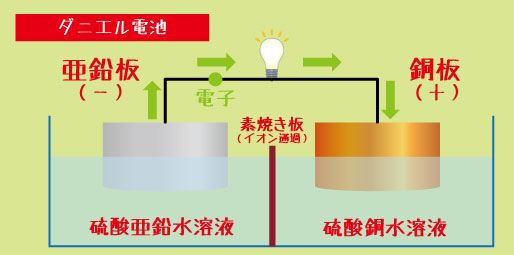
ダニエル電池とは? ― 構造と材料をおさえよう
ダニエル電池は、次の4つのパーツで構成されています。
1️⃣ 亜鉛板(-極)
2️⃣ 硫酸亜鉛水溶液(-極の液)
3️⃣ 銅板(+極)
4️⃣ 硫酸銅水溶液(+極の液)
そして、2つの液の間には「素焼き板」と呼ばれる仕切りが置かれています。この仕切りは、液が直接混ざるのを防ぎながら、イオンだけを通す“ドア”のような役割を果たします。
電子とイオンの動きを追ってみよう
ダニエル電池で電気が流れるのは、電子の移動とイオンの移動が同時に起こるからです。
-
・亜鉛板(-極)では、
→ 亜鉛が電子を放出して Zn → Zn²⁺ + 2e⁻
→ できた Zn²⁺ は液中に溶け出します。 -
・銅板(+極)では、
→ 硫酸銅水溶液中の Cu²⁺ が電子を受け取り、 Cu²⁺ + 2e⁻ → Cu
→ 銅板の表面に銅がくっついていきます。
このようにして、電子は外の回路を通って流れ、イオンは液の中を移動してバランスを保っています。結果として、連続的に電流が流れるというわけです。
🧠 ポイント:
-
・電子は金属の外を流れる(=電線を通る)
-
・イオンは液の中を移動する
→ この2つの動きを区別して理解するのがカギ!
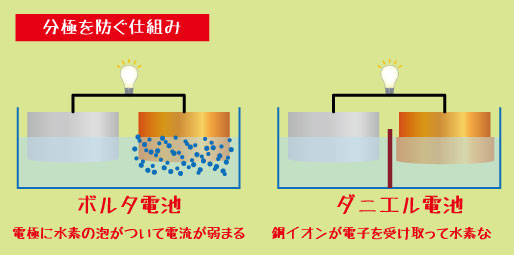
分極を防ぐ仕組みとダニエル電池の強み
ボルタ電池では、反応の途中で発生する「水素の泡(H₂)」が電極表面を覆い、電流を弱めてしまう“分極”が起こりました。
ダニエル電池では、水素が発生しない反応を利用しているため、この問題を解決しています。
つまり、ダニエル電池では、
-
+極で水素ではなく「銅イオン(Cu²⁺)」が電子を受け取る
-
結果として、水素が発生しない → 電流が安定する!
この改良により、長時間安定して電気を取り出せるようになりました。そのため、ダニエル電池は19世紀の電気実験や電信機などに広く使われたのです。
ダニエル電池は、ボルタ電池の欠点を改良し、「安定した電流」を実現した画期的な電池です。電子は金属の外を、イオンは液の中を移動する――この仕組みを理解すれば、化学電池の本質が見えてきます。
💡チェック!
-
電子は「外の回路」を流れる
-
イオンは「液の中」を動く
-
ダニエル電池は分極を防ぎ、安定した電流を生む
このしくみは、のちに登場する「乾電池」や「燃料電池」にも応用されていく重要な基礎です。
第4章:酸化と還元の関係を理解しよう
反応式をスッキリ整理!
化学電池のしくみを理解するうえで欠かせないキーワード――それが「酸化」と「還元」です。
電池の中では、「電子を出す反応」と「電子を受け取る反応」が同時に起こっています。この2つの反応を正しく整理できるようになると、ダニエル電池の反応式も、定期テストや入試の“差がつく問題”もスッキリ理解できるようになります。
ここでは、「酸化」「還元」「電子のやり取り」を、できるだけわかりやすく整理していきましょう。
まずは用語を整理!酸化と還元って何?
化学では、「酸化」「還元」という言葉をセットで使います。電池の反応を理解するには、この2つの意味をしっかり区別することが大切です。
- 酸化:電子を失う反応(電子を出す)
- 還元:電子を受け取る反応(電子をもらう)
つまり、「酸化=電子を出す」「還元=電子をもらう」と覚えましょう。そして、電子を出した物質を「還元剤」、電子を受け取った物質を「酸化剤」と呼びます。

ダニエル電池の反応式を整理しよう
ここまでの知識を使って、ダニエル電池の反応を「酸化・還元」に分けて整理してみましょう。
1) 亜鉛板(-極)で起こる反応
→ 亜鉛が電子を放出して溶ける
Zn → Zn²⁺ + 2e⁻(酸化反応)
② 銅板(+極)で起こる反応
→ 銅イオンが電子を受け取り、銅として付着する
Cu²⁺ + 2e⁻ → Cu(還元反応)
これらを合わせると、電池全体の反応式ができます。
🔹 全体の反応式
Zn + Cu²⁺ → Zn²⁺ + Cu
この1本の式に、「電子の出入り」「イオンの動き」「金属の変化」がすべて含まれています。
🧠 ポイント:
-
・酸化と還元は同時に起こる
-
・電子は「酸化側(-極)」から「還元側(+極)」へ流れる
-
・電池の反応は「酸化+還元=電気エネルギー」!
酸化・還元をテストで見抜くコツ
定期テストや入試では、「どちらが酸化?還元?」という問題がよく出ます。
迷ったときは、次の2ステップで考えましょう!!
✅ ステップ①:電子を出しているのはどっち?
電子を出している金属が「酸化される(=-極)」です。
→ 亜鉛が電子を出してZn²⁺になる → 酸化!
✅ ステップ②:電子をもらっているのはどっち?
電子を受け取っているイオンが「還元される(=+極)」です。
→ 銅イオンが電子を受け取ってCuになる → 還元!
この2つをセットで覚えれば、ほとんどの問題は瞬時に見抜けます。
ダニエル電池の反応を整理すると、「酸化=電子を出す」「還元=電子を受け取る」という基本ルールがはっきり見えてきます。
💡チェック!
-
・酸化と還元はペアで起こる
-
・電子を出すのが酸化、受け取るのが還元
-
・反応式は「Zn + Cu²⁺ → Zn²⁺ + Cu」
この理解ができると、化学電池だけでなく「酸化・還元」を扱うすべての単元(呼吸、燃焼、電気分解など)にも応用できるようになります。
第5章:いろいろな化学電池を比較!
〜乾電池・鉛蓄電池・燃料電池〜
ダニエル電池で「電気を生み出すしくみ」を理解したところで、次に知っておきたいのがいろいろな化学電池の種類です。身の回りで使われている電池は、どれも「化学反応を利用して電気を取り出す」という原理は同じですが、構造や特徴には大きな違いがあります。
この章では、乾電池・鉛蓄電池・燃料電池の3種類を中心に、しくみや使われ方を比較して整理していきましょう。
乾電池 ― いちばん身近な化学電池
まずは私たちが日常的に使っている「乾電池」から見てみましょう。リモコン、懐中電灯、時計など、ほとんどの家庭で見かけるこの電池も、実はダニエル電池の考え方がベースになっています。
〈マンガン乾電池の構造〉
- +極:二酸化マンガン(MnO₂)
- -極:亜鉛(Zn)
- 電解質:塩化アンモニウム水溶液(NH₄Cl)
反応の流れは次のようになります。
- 亜鉛(Zn)が電子を放出 → 酸化反応
- 二酸化マンガン(MnO₂)が電子を受け取る → 還元反応
この反応によって、外部に電流が流れます。
🧠 ポイント:
-
・「乾電池」という名前でも、内部は湿ったペースト状の電解質が入っている
-
・小型で扱いやすいが、使い切り(充電できない)タイプが多い
鉛蓄電池 ― くり返し使える電池
次に紹介するのは、自動車のバッテリーなどに使われている鉛蓄電池です。乾電池との大きなちがいは、充電して再び使えること。
〈鉛蓄電池のしくみ〉
- +極:二酸化鉛(PbO₂)
- -極:鉛(Pb)
- 電解質:希硫酸(H₂SO₄)
放電時には、鉛と二酸化鉛がそれぞれ反応して硫酸鉛(PbSO₄)になります。
逆に、外部から電気を流す(充電する)と、反応が逆向きに進み、再び元の物質に戻ります。
🔁 つまり!
「化学反応を逆転できる」=充電式の電池ということです。
🧠 ポイント:
-
・電解質に「希硫酸」を使用(入試で頻出)
-
・放電で電圧が下がると、硫酸の濃度も下がる
-
・充電すると反応が逆に進み、電池が再生!
燃料電池 ― 未来のエコ電池
最後に紹介するのは、近年注目されている燃料電池です。燃料電池は、これまでの電池のように「内部に反応物をためておく」タイプではなく、外から気体を供給して電気を作るという点が特徴です。
代表的なのが、水素と酸素を使う燃料電池。
〈燃料電池の基本反応〉
- -極(燃料極):水素(H₂)が電子を放出 → 酸化
- +極(空気極):酸素(O₂)が電子を受け取り → 還元
- 全体の反応:2H₂ + O₂ → 2H₂O(+電気エネルギー)
このときに生まれるのは水だけ。有害な排出物が出ないため、非常に環境にやさしいのが大きな特徴です。
🧠 ポイント:
-
・電気+水が生まれる「クリーンエネルギー」
-
・水素自動車などに応用されている
-
・将来のエネルギー技術としても注目度が高い!
3種類の化学電池を比べると、それぞれの特徴が見えてきます!!
乾電池 :小型、使い切り 【例)家庭用製品】
鉛蓄電池:充電で再利用可 【例)自動車バッテリー】
燃料電池:クリーン、持続供給型【例)水素自動車】
💡チェック!
-
・電池は「酸化と還元」を利用して電気を生み出す
-
・乾電池=使い切り、鉛蓄電池=充電式、燃料電池=補給式
-
・各電池の構造と反応物はテストでも頻出!
第6章:頻出ポイントとひっかけ対策まとめ
これまでの章で、化学電池の基本からボルタ電池・ダニエル電池、酸化・還元の整理、さまざまな電池の特徴まで学びました。
しかし、学んだ知識をそのまま定期テストや入試に活かすには、出題されやすいポイントやひっかけ問題のパターンを押さえることが大切です。
この章では、中学理科のテストで絶対に得点源になる内容をまとめ、実践的に整理していきます。
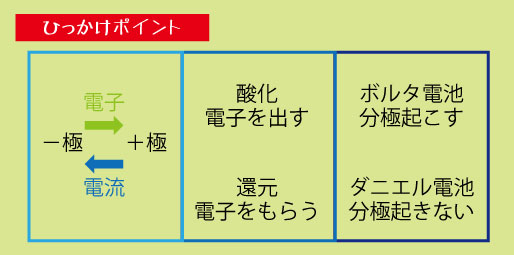
頻出ポイント① ― 電極・極性・電子の流れ
化学電池では、次の3つはテストで必ずと言っていいほど出ます。
1️⃣電子の流れの方向
-
電子は「−極(亜鉛など) → +極(銅など)」に流れる
-
注意:電流の向き(+極 → −極)は逆
2️⃣酸化・還元の関係
-
電子を出す側が酸化(=−極)
-
電子を受け取る側が還元(=+極)
3️⃣電解液の役割
-
電子は金属の外を通るが、イオンは液の中を移動して回路を完成させる

頻出ポイント② ― 電池の種類と特徴
テストでは「電池の種類のちがい」を問う問題も多いです。特に覚えておくべき比較ポイントは次の通りです。
乾電池 →電極:Zn/MnO2、電解液:塩化アンモニウム、充電✕、小型・使い切り
鉛蓄電池→電極:Pb/PbO2、電解液:希硫酸、充電〇、自動車
燃料電池→電極:H2/O2、充電△、クリーン、水素自動車
🧠 ポイント:
-
・「充電できるかどうか」を押さえる
-
・電極・電解液の組み合わせはテスト頻出
-
・燃料電池は水だけが生成されることも覚えておく
ひっかけ対策 ― 分極・電子の向き・酸化還元
テストでよくある“ひっかけ問題”は次の3つです。
1️⃣電子と電流の向きを逆に答える問題
-
電子は−極→+極
-
電流は+極→−極
-
→ 逆に書かないよう注意!
2️⃣ 酸化還元の混乱
-
「電子をもらう=酸化?」など誤答しやすい
-
覚え方:酸化=電子を出す、還元=電子をもらう
3️⃣ 分極の知識問題
-
ボルタ電池では水素が発生 → 電流が弱まる(分極)
-
ダニエル電池では銅イオンで分極防止
-
→ 分極の仕組みのちがいを押さえる
定期テスト・入試での攻略法
-
反応式は酸化・還元のペアで整理
-
電子の流れとイオンの動きを同時に確認
-
電池の種類や特徴は表にまとめて覚える
-
「充電できる?できない?」をチェック
-
問題文の「電子の流れ」「電流の向き」に注意
この5つを意識すれば、化学電池はテストで必ず得点源になります!

ここまで学んだことを整理すると、化学電池のテスト対策は次の3つに集約できます。
1️⃣ 電子の流れ・酸化還元・イオンの動きを整理する
2️⃣ 電池の種類・構造・充電の可否を覚える
3️⃣ ひっかけポイント(電子と電流の向き・分極・酸化還元)を押さえる
💡 チェック!
この3つができれば、定期テスト・入試の化学電池問題は確実に得点源になります。次回以降のテストで迷ったら、まずこのまとめ表を思い出してみましょう!
第7章:差がつく応用問題にチャレンジ!
化学電池の基礎から、ボルタ電池・ダニエル電池、酸化・還元の整理、電池の種類まで学んできました。ここからは、入試で差がつく応用問題に挑戦してみましょう。
問題を通して、「電子の流れ」「酸化還元の整理」「電池の特徴」を総合的に使う力を養うことが目的です。
これに慣れると、難しい問題でも落ち着いて解けるようになります。
電極の材質と電流の向き
問題例
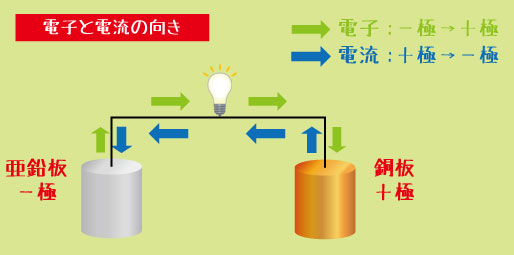
ある電池の−極に亜鉛板、+極に銅板を使ったとき、電子の流れる方向と電流の向きを答えなさい。
解説
-
電子は「−極→+極」に流れる → Zn → Cu
-
電流は「+極→−極」に流れる
-
このとき、亜鉛が酸化、銅イオンが還元
✅ ポイント:
-
電子と電流の向きを逆に答えないように注意
-
入試では「酸化・還元」をセットで確認する問題が多い
電池の電圧と種類の判断
問題例
次の特徴から電池の種類を答えなさい。
-
電極:Pb/PbO₂
-
電解液:希硫酸
-
充電可能
解説
-
充電できる → 蓄電池
-
電極と電解液の組み合わせ → 鉛蓄電池
-
+Point 放電するとPbとPbO₂がPbSO₄になる
🧠 ポイント:
-
電極・電解液・充電の可否は入試頻出の組み合わせ問題
-
表を作って整理すると解きやすい
反応式から電子の移動を考える
問題例
次の反応式のうち、酸化・還元を正しく判断しなさい。
Zn + Cu²⁺ → Zn²⁺ + Cu
解説
-
Zn → Zn²⁺ + 2e⁻ → 酸化(電子を出す)
-
Cu²⁺ + 2e⁻ → Cu → 還元(電子をもらう)
-
電子はZn→Cuに流れる
✅ ポイント:
-
反応式を見て酸化還元を整理する
-
電池の極性や電子の流れとセットで考える
分極や特殊条件のひっかけ
問題例
ボルタ電池で長時間使ったときに電流が弱まる理由を答えなさい。
解説
-
ボルタ電池では+極に水素が発生 → 電極表面を覆う
-
電子の流れが妨げられる → 分極
-
+Point ダニエル電池では銅イオンが電子を受け取るため分極なし
✅ ポイント:
-
分極の仕組みを押さえると入試のひっかけ問題を回避できる
入試レベルの応用問題は、これまで学んだ知識の組み合わせ問題です。
💡 攻略のコツ
1️⃣ 電子の流れ・電流の向き
2️⃣ 酸化・還元の整理
3️⃣ 電池の種類・構造・充電の可否
4️⃣ 分極や特殊条件の理解
これらのポイントを整理して問題に取り組めば、化学電池は入試で差がつく得点源になります。実際に図を描きながら反応の流れを確認すると、さらに理解が深まります。
化学電池を「得点源」にするために覚えるべきこと3つ
化学電池は、ただ覚えるだけではなく、「しくみを理解して使える知識」にすることが大切です。
このコラムでは、ボルタ電池・ダニエル電池・乾電池・鉛蓄電池・燃料電池などの構造や反応、酸化・還元の整理、電子の流れとイオンの動きまでを詳しく解説してきました。その知識をもとに、テストや入試で差がつくポイントを押さえれば、化学電池はまさに得点源になります。
では、化学電池を得点源にするために、まず覚えてほしいことを3つにまとめます。
電池では、電子は金属の外を、イオンは液の中を移動することを忘れないでください。
電子は−極から+極へ流れ、酸化・還元の反応が連動していることを押さえるだけで、反応式や電極の極性、電流の向きが自然と理解できるようになります。
テストでは、電子と電流の向き、酸化と還元の組み合わせを問われる問題が頻出です。ここを正確に理解しておくことが、得点の安定につながります。
乾電池・鉛蓄電池・燃料電池など、身近な電池の違いを整理して覚えましょう。
-
乾電池:小型・使い切り
-
鉛蓄電池:充電可能・自動車など
-
燃料電池:水素+酸素でクリーンに電気を生む
充電の可否、電極や電解液の組み合わせ、生成物の違いなどを表にまとめると、テストでも瞬時に答えられるようになります。
入試では、分極のしくみや電子と電流の向きの逆表記、酸化・還元の混乱など、ちょっとしたひっかけが出題されます。反応式を「酸化・還元のペア」として整理する習慣をつけると、複雑な問題でも落ち着いて解けるようになります。
図や表を活用して整理すると、理解がより深まり、応用問題にも強くなります。
化学電池は、原理をしっかり理解すれば、決して難しくありません。
電子の流れ、酸化・還元、電池の種類と特徴をひとつひとつ整理して覚えることで、定期テストや入試で確実に得点できます。最初は少し複雑に感じるかもしれませんが、図を描きながら反応の流れを確認したり、表で特徴を整理することで、理解がぐんと進みます。
そして何より、「理解したら覚えなくても思い出せる」状態にすることが重要です。今日学んだことを繰り返し確認しながら、自分で図や表にまとめることで、化学電池は得点源になります。
さあ、次のテストでは、
自信を持って「化学電池の問題は得意だ!」と言えるように、
このまとめを活用してください。
一歩ずつ着実に学んでいけば、
化学電池はあなたの強力な武器になります!
お子さまの学習にお悩みの保護者の方へ。

当塾では、一人ひとりの理解に合わせた“意味のある学び”を大切にした指導を行っています。「〇〇がニガテ」「家庭学習で何をすればいいかわからない」といったご相談も、お気軽にお寄せください。まずは、無料体験授業で教え方の違い、学びの楽しさをご体感ください。
※一人ずつ個別で対応させていただいていますので、【事前予約制】となっています。
お気軽にどうぞ!!
こちら各種SNSでも情報配信中です。参考にしてみてください。
/
この記事は 1,653人 に閲覧されています。
.jpg)




電池と化学電池のちがいを知ろう
まずは言葉の整理から。
「電池」とは、化学反応などによって電気を生み出す装置のこと。その中でも、化学反応を利用して電気をつくるものを特に「化学電池(chemical cell)」と呼びます。
たとえば、私たちがよく使う乾電池やボタン電池。これらはすべて化学電池の仲間です。内部では金属や液体が反応し、電子を発生させています。
つまり、化学電池とは――
化学エネルギー → 電気エネルギー に変える“変換装置”なのです。